PRESENTACIÓN

“...Y aún dicen que el pescado es caro."
Como dijo aquél: “Yo tengo la solución para arreglar la crisis económica: ¡que la Fábrica de Moneda y Timbre...fabrique más monedas y deje de fabricar timbres!”. Pintoresco ¿verdad? Pero no lo son menos algunas opiniones acerca de abaratar el precio de los medicamentos (que seamos autosuficientes y prescindamos de la producción de otros países, que sea el estado quien se encargue de fabricarlos, etc, etc...) Las soluciones sencillas no siempre son buenas soluciones (la verdad es que casi nunca) Ya dijo alguien que “Para cada problema complejo, siempre existe una solución simple, elegante...y totalmente equivocada”.
¿Por qué hoy en día se han encarecido tanto los medicamentos? Porque las cosas no son como antes. Cuando se descubrió la penicilina, se ensayó un grupo reducido de pacientes y se comprobó su eficacia, se generó su utilización y no se hicieron más investigaciones.
Pero hoy no es así. Actualmente, el proceso de fabricación de un medicamento, desde las primeras investigaciones en tubo de ensayo hasta la aparición (en palabras de Manuel Pérez Fernández) “de la primera cápsula” debidamente empaquetada en el mostrador de la farmacia, debe seguir una larga, penosa, arriesgada y carísima navegación (abocada al fracaso la mayoría de las veces) digna de las dificultades de Ulises en su vuelta a Ítaca.
Hoy se exige que todo nuevo medicamento sea eficaz (que sirva), efectivo (que su eficacia sea lo suficientemente importante) y eficiente (que exista una buena relación entre coste y beneficio; ya saben: “eficiente: lo que le gusta al Gerente”). En lenguaje llano, bueno, bonito y barato, como las ofertas del Cortinglés. Eso lleva a la realización de los llamados “ensayos clínicos” con diseños extremadamente rigurosos en todas sus fases.
Pero no es suficiente: por encima de todo, prima la seguridad de todo aquel que participe en el proceso previo de los ensayos y, naturalmente, la del paciente, su objetivo final. El Código de Nürenberg, que surgió de los Juicios (1945-46) contra la jerarquía nazi y algunos médicos por el tratamiento inhumano a prisioneros de campos de concentración, abordó por primera vez la obligatoriedad del Consentimiento informado al paciente y la ausencia de coerción. Sus conclusiones fueron desarrolladas posteriormente en la Declaración de Helsinki (aprobada en 1954 y revisada posteriormente) por iniciativa de la Asociación Medica Mundial y, todo ello culminó en el Informe Belmont (USA, 1979) que, a raíz de los intolerables experimentos en sífilis en Alabama y Guatemala, abordó la obligatoriedad de cumplimiento de los Principios Bioéticos: de beneficencia (entendido como “hacer el bien”), de no-maleficencia, de autonomía y de justicia.
Todo ello, magistralmente expuesto a continuación por nuestro ya habitual invitado de hoy en “Tribuna...”, lleva a un considerable sobrecoste y consecuentemente unas elevadísimas inversiones (para que digan luego “...que todo el pescado es caro”, como lamenta el genial y dramático cuadro de Sorolla). La reducción de precios no es cosa fácil. Probablemente venga de la mano de los avances en tecnología, en el conocimiento de la genética, en la aplicación de los avances en inteligencia artificial...pero, desde luego, no del aumento de fabricación de moneda a expensas de dejar de fabricar timbres.
Julio Sánchez Román
Secretario de AADEA
ARTÍCULO
“Fabricar millones de cápsulas de un medicamento
no es caro ni complicado;
lo caro y complicado es llegar a fabricar
la primera cápsula de un medicamento”.
Poner un nuevo medicamento a disposición del Médico prescriptor, disponer de él en una Farmacia para ser dispensado y administrado al paciente que lo necesite, es una tarea compleja que requiere culminar los procesos de I + D + i, o sea, haber realizado la investigación necesaria para desarrollar un producto a partir de un principio farmacológicamente activo, siempre y cuando suponga una innovación terapéutica contrastada.
Por lo general, cada nuevo medicamento registrado aporta numerosos beneficios en salud para los pacientes destinatarios del mismo. De igual modo, reporta grandes ingresos a los laboratorios fabricantes, que van a disponer de un periodo de comercialización en exclusiva, habitualmente en torno a diez años, para amortizar y rentabilizar la inversión en salud realizada, o sea, los gastos en I + D + i (“el costo de esa primera cápsula”). Finalizado este periodo se produce la caducidad de la patente y la exclusividad de la comercialización, pudiéndose aprobar la fabricación de los llamados medicamentos genéricos a otros laboratorios que tramiten y consigan la pertinente autorización. Al no tener que soportar más que los gastos de fabricación los precios de los medicamentos genéricos serán claramente menores.
La aprobación de un medicamento genérico sólo se producirá tras la demostración de bioequivalencia con el correspondiente medicamento original, previamente autorizado, y para el que ha expirado el periodo de protección de patente (es decir, que hayan transcurrido al menos diez años desde su autorización). El medicamento genérico debe tener igual composición y forma farmacéutica, la misma biodisponibilidad y cumplir con todas las garantías de calidad exigibles por las autoridades sanitarias competentes. Además, debe demostrar que el principio activo se absorbe por el organismo de la misma manera que su correspondiente medicamento original.
Como consecuencia de la caducidad de numerosas patentes en los últimos años, los medicamentos genéricos han multiplicado su cuota de mercado en unidades y en valores desde 2001, llegando a alcanzar respectivamente el 40% en unidades y el 21% en valor en España, aunque muy lejos aún de las cifras europeas que son del 65% y el 25% del mercado.
La caducidad de las patentes actúa como motor de la investigación terapéutica, pues motiva a los fabricantes de medicamentos “de marca” a explorar nuevas moléculas para desarrollar y registrar nuevos medicamentos, y mantener así la rentabilidad y el valor bursátil de los laboratorios, la mayoría de ellos multinacionales.
No obstante, no es sólo la caducidad de las patentes la que incentiva la búsqueda de nuevas moléculas. La industria farmacéutica per se y los grupos investigadores no cesan en su empeño de descubrir nuevos remedios para curar las enfermedades o, al menos, cronificarlas, y mejorar la calidad o las perspectivas de vida de los pacientes.
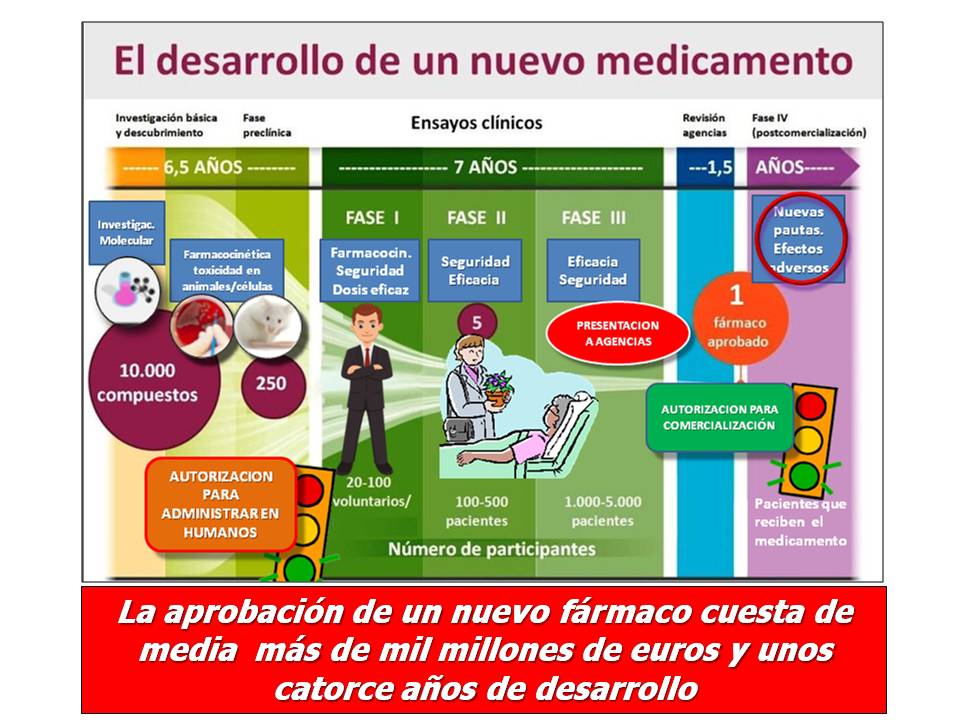
Desarrollar un nuevo medicamento no es fácil, antes al contrario, es un proceso complejo y muy costoso, debido a que al ser los reguladores quienes asumen la responsabilidad de su autorización, puesta en el mercado y financiación, quieren conocer casi el cien por cien de las características del nuevo fármaco para minimizar los riesgos a los potenciales pacientes. Entre los ejemplos más recordados de medicamentos retirados tras su autorización debido a la aparición de efectos secundarios o no deseados, destaca el de la Talidomida, principio activo indicado para combatir las náuseas del embarazo, que ocasionó el nacimiento de niños con malformaciones gravísimas como consecuencia de la ingestión por parte de sus madres embarazadas de medicamentos que la contenían.
La Talidomida alcanzó una aceptación sin precedentes, porque se afirmaba que carecía de efectos secundarios al conocerse su estructura química y su comportamiento. ¿Qué ocurrió entonces? ¿Cuál fue la causa de esos efectos secundarios que aparecieron tras su uso generalizado? La investigación descubrió la existencia de dos talidomidas distintas, aunque de igual fórmula química molecular, que se diferenciaban en la disposición de los radicales en un átomo de carbono concreto, algo que hasta entonces no se tenía en cuenta. Las dos moléculas de Talidomida diferentes eran formas enantiómeras: la forma R era la responsable del efecto sedante, mientras que la forma S era la responsable de los efectos teratogénicos. Ambas moléculas eran químicamente idénticas, pero espacialmente diferentes (eran imágenes especulares). Esta “simple diferencia molecular” ocasionó gravísimos efectos no deseados en los neonatos cuyas madres tomaron medicamentos con Talidomida para combatir las habituales nauseas del embarazo.
A partir de ese suceso se le dio una gran importancia a conocer todos los detalles de cada molécula utilizada para elaborar medicamentos, elevándose las exigencias y los controles previos a su autorización.
Investigar, desarrollar y comercializar un nuevo medicamento hace necesario, por tanto, conciliar beneficio social, seguridad de acción, acceso a los medicamentos y rentabilidad de las compañías. Se calcula en 1.294 millones de dólares la inversión media (casi el doble de la de hace una década) y en 14 años el tiempo hasta el lanzamiento del medicamento al mercado desde el descubrimiento de la molécula activa. Los costes y los tiempos van a variar en función de las compañías y del tipo de producto a desarrollar lo que, a veces, alarga el periodo de I+D, incrementando los costes, el precio solicitado de registro, etc…
El cálculo de la dosis terapéutica de un medicamento es una tarea tremendamente compleja, que debe establecerse tras la realización de las correspondientes fases de los ensayos clínicos. Theophrastus Bombast von Hohenheim, más conocido por el sobrenombre de Paracelso (1493-1541), fue un alquimista, médico y astrólogo suizo que, realizando investigaciones en el campo de la mineralogía, encontró aplicaciones medicamentosas para combatir determinadas enfermedades (mercurio en la sífilis, por ejemplo), y dejó un aserto para la posteridad que define la tenue línea que separa el beneficio del perjuicio: “Todo es veneno, nada es veneno, sólo la dosis hace al veneno”.
Hasta épocas recientes no existían regulaciones legales por lo que los investigadores se debían regir por su profesionalidad: “Primum non nocere” (“Lo primero, no hacer daño”). La ausencia de normativa aumentaba la responsabilidad de la práctica profesional, a la par que les permitía llevar a cabo determinadas actuaciones que hoy día están absolutamente prohibidas por la legislación. Su afán por sanar a los pacientes, y el convencimiento de los beneficios de sus actos, junto a su osadía profesional, fueron abriendo caminos que les llevaron a conseguir grandes avances en la terapéutica. Baste citar a Edward Jenner, Pasteur o a Pierre y Marie Curie para ilustrar lo que decimos.
Para conseguir el necesario conocimiento terapéutico, hay que tener nociones importantes de Botánica, Mineralogía, Química Orgánica, Química Farmacéutica, Bioquímica,…
Inicialmente se utilizaban productos naturales con probada y conocida actividad medicinal (animal, mineral o vegetal). Posteriormente se empezó a investigar, descubrir e identificar la fracción activa de las plantas que se utilizaban (planta entera, raíz, tallos, hojas, flores, frutos,…) y la forma en que debían utilizarse (planta entera, polvos, cocimientos, infusiones, extractos,…); de igual forma se procedía con los animales (polvo de Cantáridas, Castóreo…).
Tras conocer la fracción activa de la materia prima (la denominada “droga”), se investiga para identificar el principio activo y la estructura química de los principios responsables de la actividad. Una vez alcanzados estos objetivos, el reto siguiente fue descubrir los procesos de síntesis de los principios activos, o sea, del conjunto de reacciones químicas que ocurren para su fabricación, abriéndose de este modo las puertas a la fabricación industrial de los principios activos.
Pero ese no era el fin del camino sino una etapa más. Quedaba otro trecho igual o más importante: introducir modificaciones en la estructura química con el objeto de obtener nuevos medicamentos, mejorar la actividad farmacológica y las propiedades químicas y disminuir o minimizar los efectos secundarios de la molécula original. Estos desarrollos en el conocimiento de la química de los medicamentos han conseguido que la farmacoterapia haya avanzado más en los últimos cien años que en toda la historia de la humanidad.
No obstante, sería un error minimizar la importancia de los conocimientos farmacéuticos del pasado, pues son la base de los actuales.
Es obvio que en pleno siglo XXI no resulta rentable recolectar plantas medicinales como única fuente de materias primas para fabricar medicamentos. No lo era ya en los albores del pasado siglo. Los conocimientos adquiridos, mencionados en los párrafos anteriores, permiten la fabricación industrial de medicamentos utilizando las sustancias químicas y los productos naturales igual que hace decenas de años: la aspirina, la morfina, la digitalina, y muchos otros fármacos comunes, tienen este origen, aunque obtenidos industrialmente gracias a la investigación farmacéutica.
Los procesos de investigación farmacológica siguen el siguiente orden:
- Extracción de muestras
- Aislamiento
- Identificación
- Selección de principios activos
- Purificación
- Realización de pruebas, estudios y ensayos para determinar su posible uso en seres humanos
- Mejoramiento de sus propiedades mediante Química Farmacéutica
- Evaluación de toxicidad in vitro y en cultivos celulares
- Ídem in vivo (en animales de experimentación: roedores, perros y monos)
- Realización de ensayos clínicos si los resultados lo permiten (a fin de estudiar posibles efectos adversos del medicamento en humanos, tanto en voluntarios sanos como en pacientes y enfermos)
- Comparación del fármaco con un placebo o con otro tratamiento en pacientes, a gran escala
- Si todo este proceso se ha realizado con éxito, el laboratorio fabricante solicitará el registro y la autorización de comercialización del nuevo medicamento
Los avances en la investigación han aportado seguridad y llevado aparejada la confianza del ciudadano en las ciencias médicas. No obstante, siempre existirán incrédulos, como por ejemplo los movimientos actuales anti-vacunas espoleados tras la pandemia de Covid-19, que siguen poniendo en entredicho los resultados en salud de las terapias actuales, lo que los sitúa en la proximidad del pensamiento de Voltaire (1694-1778), uno de los principales representantes de la Ilustración, que exclamó "Desgraciado, ¡cómo se atreve a estudiar un arte que consiste en administrar venenos que no conoces a organismos que todavía conoces menos!” cuando tuvo conocimiento de que un sobrino suyo pensaba estudiar medicina.

Manuel Pérez Fernández
Farmacéutico
Presidente del Real e Ilustre Colegio Oficial de Farmacéuticos de Sevilla (2000-2023)
Académico Correspondiente de la Iberoamericana de Farmacia

