PRESENTACIÓN
Ensayos clínicos: historia, ética y progreso médico.
Internista de referencia y experto en enfermedades autoinmunes sistémicas, el Dr. Enrique de Ramón (socio fundador y directivo de AADEA) nos invita a reflexionar sobre uno de sus temas predilectos: la importancia de los ensayos clínicos en el progreso de la Medicina. En un artículo anterior (Tribuna de Asociados: Investigación de medicamentos), el Dr. Pérez Fernández describía el largo recorrido que exige hoy la creación de un nuevo medicamento: desde la primera intuición hasta su llegada al mostrador de la farmacia. El Dr. De Ramón, más concretamente, se centra ahora en el ensayo clínico con estreptomicina, de 1946, considerado, como él mismo relata, el primero en cumplir rigurosamente los estándares actuales exigidos para la aprobación de un fármaco, ya que no solo evaluó su eficacia (mediante aleatorización, enmascaramiento y diseño estadístico riguroso), sino que se adelantó, de manera incipiente, al respeto a los principios bioéticos de seguridad y libertad de los pacientes (consentimiento informado y equidad en la selección). Exigencias bioéticas que, bajo su influencia, serían concretadas e impulsadas por el Código de Núremberg (1947) y se consolidaron posteriormente en la Declaración de Helsinki (1954) y en el Informe Belmont (1979), ambos surgidos como respuesta a prácticas éticamente reprobables en ciertos ensayos previos. Conviene destacar que, en contraste con el rigor del estudio analizado por el doctor De Ramón, nada parecido se realizó con la penicilina, lanzada al uso clínico tras unos tanteos iniciales muy simples en una fecha tan próxima como 1941.
El progreso de la Medicina se sustenta, sin duda, en la investigación que, en última instancia, requiere la experimentación con seres humanos. Esta experimentación ha ido perfeccionándose paso a paso: desde sus balbuceos empíricos iniciales al refinamiento actual del diseño y de la estadística, seguido por los avances en el ámbito regulatorio y ético. La prioridad es clara: garantizar la seguridad y el bienestar de quienes participan en los estudios por encima del avance científico. Hasta llegar a la situación actual, a lo largo de la historia han existido numerosos ejemplos sencillos, pero con un claro espíritu científico de “ensayo de ensayo” clínico. El más antiguo conocido (más de 500 años a. C.) aparece en la Biblia, en el "Libro de Daniel", donde el profeta, bajo el reinado de Nabucodonosor, expuso los efectos superiores sobre la salud de una dieta vegetal frente a otra basada en carne. Muchos siglos después, en 1537, el cirujano militar francés Ambroise Paré comprobó la superioridad del tratamiento de heridas de bala con ungüentos a base de trementina frente al uso de aceite hirviendo utilizado hasta entonces. En 1747, James Lind, médico de la Marina británica, realizó el que se considera el primer ensayo clínico, como tal, de la era científica, demostrando la eficacia de naranjas y limones en la prevención del escorbuto. El estudio del ginecólogo Ignaz Semmelweis (en 1847) sobre el control de la fiebre puerperal mediante medidas de asepsia (lavado de manos con hipoclorito antes de atender a las parturientas) constituyó un estudio cuasi-experimental o pre-experimental, precursor histórico de los ensayos clínicos. Austin Flint introdujo en 1863 el uso del “placebo” (medicamento simulado) como elemento comparativo en el tratamiento del reumatismo y, en 1943, se aplicó por primera vez el método de “doble ciego” en un ensayo sobre la patulina (extracto de Penicillium patulinum) como tratamiento para el resfriado común que, dicho sea de paso, resultó ser ineficaz. Finalmente, el concepto de “aleatorización”, introducido por Ronald A. Fisher en la década de 1920 en el ámbito agrícola, se incorporó a la Medicina en 1946, precisamente en el estudio que analiza el doctor De Ramón, dirigido por el doctor Austin Bradford Hill, que, indudablemente, sentó además las bases para la ética de la investigación clínica al demostrar que la metodología y la ética científica pueden converger para garantizar tratamientos justos y eficaces. Y esta historia no ha terminado. La irrupción de nuevas herramientas tecnológicas, como la inteligencia artificial y el análisis masivo de datos (big data), permite ya procesar ingentes cantidades de información en tiempo real, acelerar los procesos de investigación, optimizar la selección de participantes e identificar patrones y predicciones sobre los tratamientos más eficaces, que antes requerían años para descubrirse.
Julio Sánchez Román
Secretario de AADEA
ARTÍCULO
 Aunque la tuberculosis era en ese tiempo una de las causas principales de mortalidad en el mundo desarrollado, la situación empezó a cambiar al inicio del siglo XX en el primer mundo con la mejora de las condiciones de vida, lo que no sucedió en los países de bajo nivel socioeconómico, con factores, como la desnutrición, como principales responsables. Se calcula que en la actualidad, aproximadamente el 25% de la población global padece infección tuberculosa, lo que supuso 10.600.000 millones de episodios de enfermedad tuberculosa en 2022. Este dato coloca a la tuberculosis como la segunda enfermedad infecciosa más mortal tras la COVID-19.
Aunque la tuberculosis era en ese tiempo una de las causas principales de mortalidad en el mundo desarrollado, la situación empezó a cambiar al inicio del siglo XX en el primer mundo con la mejora de las condiciones de vida, lo que no sucedió en los países de bajo nivel socioeconómico, con factores, como la desnutrición, como principales responsables. Se calcula que en la actualidad, aproximadamente el 25% de la población global padece infección tuberculosa, lo que supuso 10.600.000 millones de episodios de enfermedad tuberculosa en 2022. Este dato coloca a la tuberculosis como la segunda enfermedad infecciosa más mortal tras la COVID-19.
Antes y después del descubrimiento de la estreptomicina
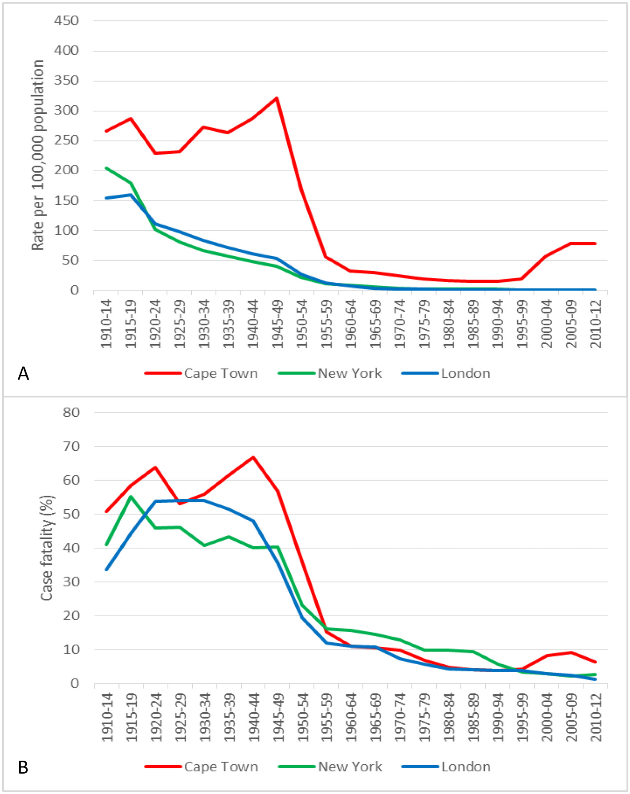
El epidemiólogo británico Thomas McKeown demostró que el tratamiento con estreptomicina había reducido el número de fallecimientos por tuberculosis desde su introducción, en 1948, hasta 1971, en un 3’2%. No obstante, también pudo demostrar que la mortalidad por tuberculosis en Inglaterra y Gales se había reducido en 90-95% antes de que la estreptomicina y la vacunación con la BCG estuvieran disponibles, concluyendo que la contribución de los antibióticos al descenso de la mortalidad por tuberculosis había sido muy pequeña, explicando que el descenso de la mortalidad por enfermedades infecciosas en general se debió a una mejoría de las condiciones de vida, especialmente mejor situación nutritiva y condiciones higiénicas. Esta situación se ha confirmado más recientemente en los países occidentales, como se ha descrito en USA.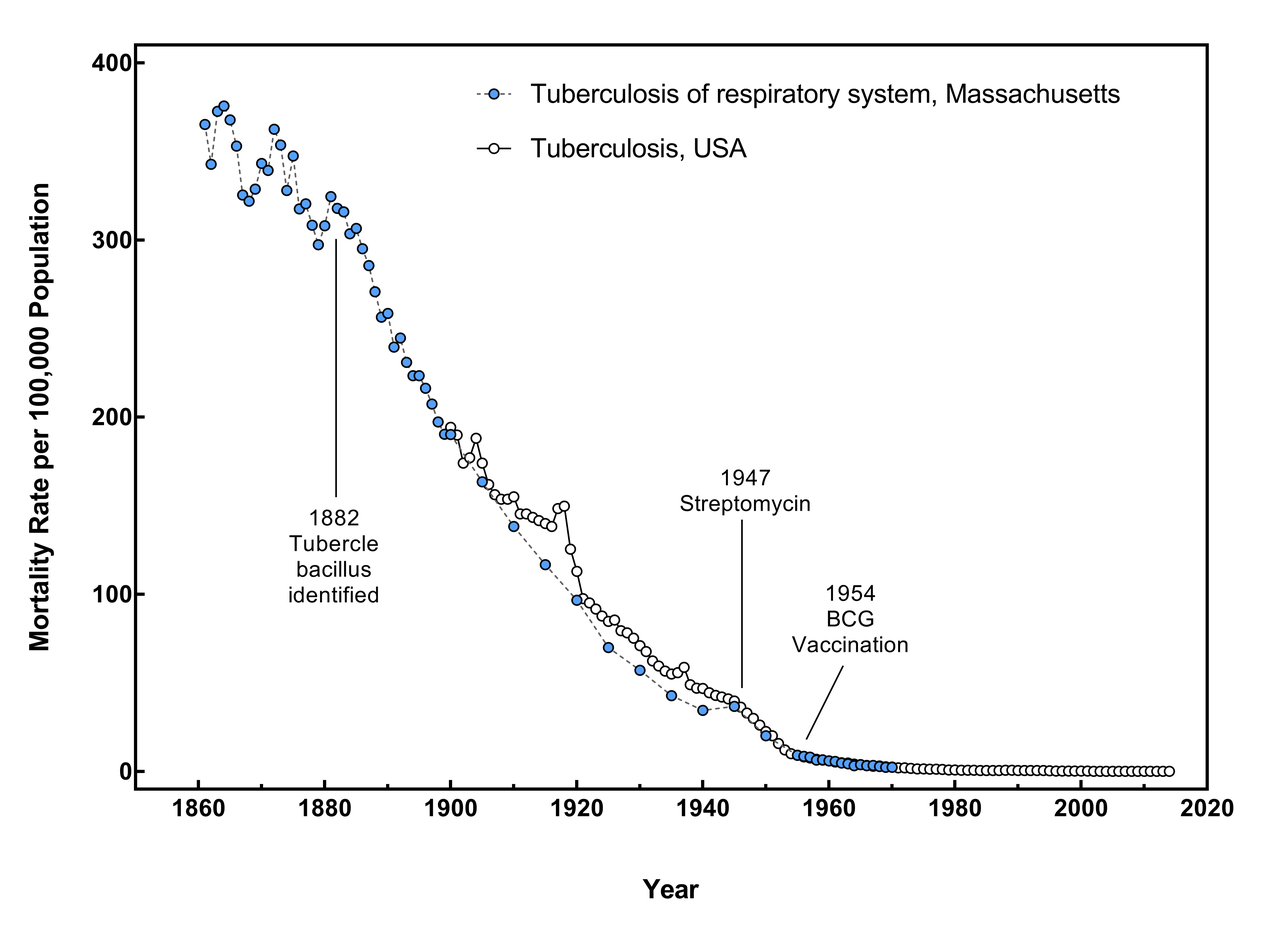
El primer ensayo clínico
Una vez que se demostró su efectividad en el laboratorio y en animales, era necesario probarlo en humanos. El primer ensayo clínico a gran escala se realizó entre 1946 y 1947 en el Reino Unido, bajo la dirección del British Medical Research Council (BMRC). Este estudio es famoso no solo por sus resultados, sino también por su innovadora metodología, que sentó las bases de los ensayos clínicos modernos. Fue el primer ensayo clínico controlado y aleatorizado de un fármaco. Los pacientes con tuberculosis pulmonar grave fueron divididos al azar en dos grupos: uno que solo recibía la atención habitual (reposo en cama) y otro que recibía inyecciones de estreptomicina, además de dicha atención estándar. Los hallazgos fueron dramáticos. Los pacientes tratados que recibieron estreptomicina mostraron una mejora clínica y radiológica significativa en comparación con el grupo de pacientes control. Este ensayo demostró por primera vez que la tuberculosis era una enfermedad curable en algunos casos, transformando el pronóstico de millones de personas y marcando el comienzo de la era de los antibióticos para combatir esta enfermedad. La escasez de estreptomicina fue un factor clave en esta historia, porque influyó en el diseño del ensayo clínico. En el período de posguerra, la producción del fármaco era limitada y la demanda enorme, especialmente porque se producía principalmente en Estados Unidos y su exportación estaba controlada. Cuando el BMRC del Reino Unido obtuvo un suministro limitado, el Dr. Austin Bradford Hill propuso que, dado que no había suficiente medicamento para todos los pacientes con tuberculosis, sería ético y necesario realizar un ensayo controlado. De esta manera, se podría evaluar de forma rigurosa si el fármaco era realmente efectivo, comparando a los pacientes que lo recibían con un grupo de control que no lo recibía, y asegurando que la asignación fuera equilibrada, sin sesgos. Este enfoque no solo optimizó el uso del escaso recurso, sino que también sentó las bases para la metodología de los ensayos clínicos modernos.Metodología del ensayo clínico
Los pacientes con tuberculosis pulmonar grave y progresiva fueron divididos en dos grupos, un grupo de control que recibía únicamente reposo en cama y el grupo experimental al que se le asignó como tratamiento, también reposo en cama, más inyecciones de estreptomicina. La asignación de la estreptomicina al grupo de intervención se realizó mediante un sistema de aleatorización. La aleatorización se considera una práctica fundamental en la metodología de los ensayos clínicos. Su necesidad de basa en que las características de ambos grupos de comparación en un estudio deben ser iguales, salvo lo que respecta a la exposición a la intervención que se evalúa, de forma que ningún otro factor sea el responsable del efecto que evalúa al final del estudio. El proceso de aleatorización es equivalente a la asignación de la intervención a los sujetos participantes en base al azar1, lo que supondría arrojar una moneda al aire y plantear la decisión según caiga en una de las dos caras; ese proceso, si se hace el número suficiente de veces, conlleva una distribución aproximada del 50% para cada una de las dos opciones. En la práctica no se lleva a cabo este procedimiento, sino que se utilizan las tablas de números aleatorios que figuran en los libros de estadística desde hace décadas. En la actualidad disponemos de instrumentos informáticos muy asequibles, tales como son los generadores de números aleatorios. La razón principal para utilizar la aleatorización al asignar tratamientos a los pacientes en los ensayos clínicos es prevenir los sesgos. Se desea comparar los resultados de un tratamiento en grupos de pacientes que no difieren en sus características de forma sistemática en el resto de factores que influyen en el resultado de dicho tratamiento2. Otra razón de peso que se puede argumentar es el hecho de que la estadística es una ciencia basada en el muestreo aleatorio. En un estudio con asignación aleatoria las diferencias que podamos encontrar en los resultados entre los grupos de tratamiento son iguales que las diferencias entre muestras aleatorias de una población única. Partimos de la idea de que ambas intervenciones consiguen el mismo resultado, analizando cuál es la probabilidad de obtener el resultado de nuestro estudio si ambos grupos, tratado y no tratado, son suficientemente distintos como para rechazar la hipótesis nula de no utilidad del fármaco o intervención. Si queremos incluir el mismo número de pacientes en más de dos grupos, el procedimiento es una aleatorización en bloques, y si queremos que determinados factores pronósticos estén equilibrados, llevaremos a cabo una aleatorización estratificada.Continuación de la historia
Como se ha indicado, el ensayo demostró que los pacientes tratados con estreptomicina presentaban una mejora clínica y radiológica significativa en comparación con el grupo de control. Por primera vez, existía un tratamiento que podía curar la enfermedad. El éxito de este estudio marcó un hito, no solo por ser el primer tratamiento eficaz contra la tuberculosis, sino también por establecer un nuevo estándar en el diseño de ensayos clínicos aleatorizados para evaluar la eficacia de nuevos tratamientos médicos. Con el paso del tiempo se constató que la estreptomicina, que no había sido exactamente el primer paso en la lucha moderna contra la tuberculosis, sino que supuso una cierta mejoría, no fue la solución final. Pronto se hizo evidente que la bacteria podía desarrollar resistencias. Esto llevó a la búsqueda de nuevos fármacos y a la posterior creación de los regímenes de terapia combinada, que siguen siendo la base del tratamiento actual de la tuberculosis. Dr. Enrique de Ramón Garrido
___
Dr. Enrique de Ramón Garrido
___
-
El término aleatorio no significa caótico o desordenado, sino que tiene un significado técnico preciso. La asignación aleatoria supone que cada paciente tiene una posibilidad conocida, habitualmente una opción igual, de recibir cada tratamiento, pero no se puede predecir que tratamiento será.
-
Imaginemos series de pacientes consecutivos del mismo hospital u hospitales. Pueden no ser comparables porque los datos sean recogidos de forma retrospectiva o prospectiva y que no podamos evitar las diferencias entre ellos, debido a los cambios que se hayan producido con el paso del tiempo en el caso de hacer comparaciones con controles históricos (es importante utilizar controles contemporáneos). Si es el clínico quien decide a quién le asigna un tratamiento, probablemente habrá diferencias en las características demográficas y clínicas de los pacientes que reciben los distintos tratamientos. Pasará igual si quien toma la decisión es el paciente o se comparan los que aceptan el tratamiento con los que no lo hacen. Los mismo puede suceder si se trata de diferentes hospitales o con diferentes especialistas. Tales diferencias sistemáticas, denominadas sesgos, supondrán una sobreestimación o infraestimación de las diferencias en los efectos del tratamiento. Estos sesgos se pueden evitar usando la aleatorización.

